nmCRPC患者に対するARSI3剤の実臨床における使用と転帰を比較したDEAR試験(海外データ)

動画「nmCRPCの治療意義と治療選択」
George DJ, et al.: JAMA Netw Open. 7; e2429783, 2024.
(本研究はバイエルの支援により実施された。著者には、バイエルから講演料・コンサルタント料等を受領した者、およびバイエルの社員5名が含まれる。)
背景
序論
- 去勢抵抗性は前立腺癌において致死的な病態であり、非転移性と転移性に分けられる1,2)。
- 非転移性去勢抵抗性前立腺癌(nmCRPC)においては、3つの新規アンドロゲン受容体シグナル阻害薬(ARSI;ニュベクオ、エンザルタミド、アパルタミド)がプラセボ対照第Ⅲ相試験の結果を受けて承認され、標準治療となっている3-8)。
- nmCRPCは通常、アンドロゲン遮断療法(ADT)を長期に受けた高齢男性において発症し、ADTにより患者は生理学的年齢以上にフレイルな状態になる可能性がある9)。
- そのため、ARSIを投与されている患者の治療中止の原因は有害事象であることが多く、3つの第Ⅲ相試験における有害事象による治療中止率は、プラセボ群では7~9%であったのに対し、試験治療群では9~17%であったと報告されている4,7,8)。
- 2019年にARSIが承認されて以来、実臨床における3つのARSIの使用性や忍容性プロファイルに関する報告は乏しく、これらを直接比較した無作為化試験も実施されていない。
- 今回、nmCRPCの適応を有する3つのARSIによる治療と臨床転帰を比較するために、電子カルテを用いた大規模レトロスペクティブコホート研究(DEAR:Darolutamide, Enzalutamide, and Apalutamide in Nonmetastatic Castration-Resistant Prostate Cancer)を実施した。
- 1) Schaeffer EM, et al.: J Natl Compr CancNetw. 20; 1288-1298, 2022.(著者には、バイエルから講演料・コンサルタント料等を受領した者が含まれる。)
- 2) Gillessen S, et al.: Eur J Cancer. 185; 178-215, 2023.(本会議はバイエル、共同開発したOrion Corporation Orion Pharma(Orion社)の支援を受けたが、科学的内容や最終出版物には関与しなかった。著者には、バイエル、Orion社から講演料・コンサルタント料等を受領した者が含まれる。)
- 3) Saad F, et al.: Prostate Cancer Prostatic Dis. 24; 323-334, 2021.(本論文はバイエルの資金により執筆および編集された。著者には、バイエルから講演料・コンサルタント料等を受領した者が含まれる。)
- 4) Fizazi K, et al.: N Engl J Med. 380; 1235-1246, 2019.(本研究はバイエル、共同開発したOrion Corporation Orion Pharma(Orion社)の資金により実施された。著者には、バイエル、Orion社から講演料・コンサルタント料等を受領した者、およびバイエルの社員2名、Orion社の社員2名が含まれる。)
- 5) Hussain M, et al.: N Engl J Med. 378; 2465-2474, 2018.(著者には、バイエル、共同開発したOrion Corporation Orion Pharmaから講演料・コンサルタント料等を受領した者が含まれる。)
- 6) Smith MR, et al.: N Engl J Med. 378; 1408-1418, 2018.(著者には、バイエルから講演料・コンサルタント料等を受領した者が含まれる。)
- 7) Sternberg CN, et al.: N Engl J Med. 382; 2197-2206, 2020.(著者には、バイエル、共同開発したOrion Corporation Orion Pharmaから講演料・コンサルタント料等を受領した者が含まれる。)
- 8) Smith MR, et al.: Eur Urol. 79; 150-158, 2021.(著者には、バイエルから講演料・コンサルタント料等を受領した者が含まれる。)
- 9) Conde-Estévez D, et al.: Expert Opin Drug MetabToxicol. 18; 601-613, 2022 (本論文はバイエルの資金により執筆された。著者には、バイエルから講演料・コンサルタント料等を受領した者が含まれる。)
研究概要
目的 | nmCRPC患者に対するニュベクオ、エンザルタミド、アパルタミドの実臨床における使用と転帰を比較する。 |
|---|---|
研究デザイン | 米国の泌尿器科診療所のPrecision Point Specialty(PPS)ネットワークにおける電子カルテをレビューしたレトロスペクティブコホート研究 |
対象・方法 |
|
評価項目 |
|
- *1: 米国にてARSI 3剤すべてが使用可能となった日
- *2: 次のいずれかに該当する場合は除外した;Index date前またはindex date後30日以内に転移病変を確認、index dateから過去5年以内に非黒色腫皮膚癌を除く他の原発癌の既往歴あり、試験期間中の臨床試験への参加。
- *3: 患者が早期に死亡しない限り、追跡期間は最低6ヵ月間とした。
- *4: 初回ARSI治療の中止、他のARSIへの切り替え、mCRPCの診断、mCRPCに対する薬物治療の開始[アビラテロン、ドセタキセル、カバジタキセル、Sipuleucel-T(国内未承認)、ミトキサントロン(国内適応外)、塩化ラジウム(223Ra)]、または死亡のうちいずれか最も早く発生したものと定義した。
- *5: 初回ARSIの治療中および治療中止後30日以内に電子カルテに記録された有害事象
- *6: 疲労、転倒、骨折、発疹、認知・記憶障害、高血圧
患者背景①
| 特性 | ARSI治療コホート*1 | p値*2 | ||
|---|---|---|---|---|
| ニュベクオ群 (n=362) | エンザルタミド群 (n=382) | アパルタミド群 (n=126) | ||
| 年齢、歳 中央値[範囲 平均値[標準偏差] | 80[53~98] 79.0[8.5] | 79[55~99] 78.6[8.9] | 80[52~96] 79.2[8.8] | 0.77 |
| 年齢グループ ≦74歳 75~84歳 ≧85歳 | 109(30.1%) 154(42.5%) 99(27.3%) | 118(30.9%) 160(41.9%) 104(27.2%) | 36(28.6%) 56(44.4%) 34(27.0%) | 0.99 |
| 人種および民族 黒人/アフリカ系アメリカ人 白人 その他/不明*3 | 80(22.1%) 238(65.7%) 44(12.2%) | 82(21.5%) 254(66.5%) 46(12.0%) | 25(19.8%) 93(73.8%) 8(6.3%) | 0.36 |
| 保険加入 民間 公的 不明 | 103(28.5%) 247(68.2%) 12(3.3%) | 88(23.0%) 287(75.1%) 7(1.8%) | 32(25.4%) 94(74.6%) 0 | 0.07 |
| Index dateの時期 2019~2020年 2021~2022年 | 203(56.1%) 159(43.9%) | 255(66.8%) 127(33.2%) | 73(57.9%) 53(42.1%) | 0.009 |
| nmCRPC診断からindex dateまでの期間、月 中央値[範囲] 平均値[標準偏差] | 5.3[0~247.9] 14.8[24.6] | 3.4[0~130.0] 13.3[22.2] | 6.5[0~131.2] 14.9[21.5] | 0.08 |
| ARSIの標準用量*4での開始 あり なし | 351(97.0%) 11(3.0%) | 360(94.2%) 22(5.8%)*5 | 124(98.4%) 2(1.6%) | 0.05 |
- *1: パーセンテージは四捨五入しており、合計が100にならない場合がある。
- *2: 3つの治療コホート間の統計学的有意差は、カテゴリー変数についてはχ2 test、連続変数については一元配置分散分析パラメトリック比較によって確認された。 分布が非常に歪んでいる連続変数(PSA値、PSADT、nmCRPC診断からindex dateまでの期間)については、ノンパラメトリック検定(Wilcoxon-Mann-Whitney test)を用いて3つのコホート間の中央値を比較した。
- *3: 自己申告のアメリカインディアン/アラスカ先住民、アジア人、ヒスパニック/ラテン系、その他の人種、および未申告を含む。
- *4: 標準用量は、ニュベクオ1,200mg/日、エンザルタミド160mg/日、アパルタミド240mg/日である。
- *5: 国内におけるエンザルタミドの用法及び用量は、「通常、成人にはエンザルタミドとして160mgを1日1回経口投与する」である。[ イクスタンジ錠電子添文 2025年4月改訂(第4版)]
患者背景②
| 特性 | ARSI治療コホート*1 | p値*2 | ||
|---|---|---|---|---|
| ニュベクオ群 (n=362) | エンザルタミド群 (n=382) | アパルタミド群 (n=126) | ||
| PSA値*3、ng/mL 中央値[範囲] 平均値[標準偏差] | 3.3[0~321.4] 9.4[24.9] | 3.6[0~417.0] 12.4[38.5] | 3.4[0~114.2] 8.7[16.8] | 0.85 |
| PSA値*3グループ <2.0ng/mL ≧2.0~<10.0ng/mL ≧10.0ng/mL 欠測 | 127(35.1%) 148(40.9%) 65(18.0%) 22(6.1%) | 134(35.1%) 135(35.3%) 76(19.9%) 37(9.7%) | 47(37.3%) 48(38.1%) 27(21.4%) 4(3.2%) | 0.17 |
| PSADT*4、月 中央値[範囲] 平均値[標準偏差] | 6.8[0~100.0] 9.9[11.3] | 6.4[0.6~100.0] 13.4[21.4] | 7.4[1.2~100.0] 11.8[17.2] | 0.19 |
| PSADT*4グループ ≦6ヵ月 >6~≦10ヵ月 >10ヵ月 欠測 | 120(33.1%) 64(17.7%) 85(23.5%) 93(25.7%) | 119(31.2%) 51(13.4%) 81(21.2%) 131(34.3%) | 37(29.4%) 31(24.6%) 28(22.2%) 30(23.8%) | 0.02 |
| 前立腺癌の初回診断時のGleasonスコア*5 4~7 8~10 欠測 | 161(44.5%) 133(36.7%) 68(18.8%) | 139(36.4%) 153(40.1%) 90(23.6%) | 45(35.7%) 58(46.0%) 23(18.3%) | 0.08 |
| 追跡期間、月 中央値[範囲] 平均値[標準偏差] | 22.2[2.2~40.3] 22.8[8.7] | 22.7[0.9~41.5] 23.1[10.2] | 23.3[2.6~41.7] 23.5[10.9] | 0.80 |
- *1: パーセンテージは四捨五入しており、合計が100にならない場合がある。
- *2: 3つの治療コホート間の統計学的有意差は、カテゴリー変数についてはχ2 test、連続変数については一元配置分散分析パラメトリック比較によって確認された。分布が非常に歪んでいる連続変数(PSA値、PSADT、nmCRPC診断からindex dateまでの期間)については、ノンパラメトリック検定(Wilcoxon-Mann-Whitney test)を用いて3つのコホート間の中央値を比較した。
- *3: Index dateに最も近い日に記録された値を示す(ニュベクオ群 340例、エンザルタミド群 345例、アパルタミド群 122例)。
- *4: Sloan Kettering法を用いて、index date前12ヵ月以内に、1ヵ月以上の間隔で測定されたPSA値が少なくとも3回は0.2ng/mL以上であることに基づき算出された (ニュベクオ群 269例、エンザルタミド群 251例、アパルタミド群 96例)。なお、PSADTが100ヵ月を超えた13例は100ヵ月を上限とした。
- *5: スコアが高いほど、癌の悪性度が高いことを示す。
初回ARSI治療の中止またはmCRPCへの進行までの期間【主要評価項目(複合評価項目)】①
初回ARSI治療の中止またはmCRPCへの進行の複合評価項目イベントを認めた患者
| ニュベクオ群(n=362) | エンザルタミド群(n=382) | アパルタミド群(n=126) | |
|---|---|---|---|
| イベント数 | 134(37.0%) | 201(52.6%) | 66(52.4%) |
Kaplan-Meier推定値

複合評価項目:初回ARSI治療の中止、他のARSIへの切り替え、転移病変の確認、mCRPCの診断、mCRPCに対する薬物治療の開始[アビラテロン、ドセタキセル、カバジタキセル、Sipuleucel-T(国内未承認)、ミトキサントロン(国内適応外)、塩化ラジウム(223Ra)]、または死亡のうちいずれか最も早い発生と定義した。
初回ARSI治療の中止またはmCRPCへの進行までの期間【主要評価項目(複合評価項目)】②
- 未調整Cox比例ハザード回帰モデルでは、ニュベクオ群で複合評価項目のイベント発生リスクが低いことが示唆された
- ベースラインの共変量を調整後も、エンザルタミド群およびアパルタミド群に対するニュベクオ群のハザード比および95%CIの上限はいずれも1.00を下回っており、ニュベクオは複合評価項目のイベント発生リスクの低下と関連していた

Cox比例ハザード回帰モデル
複合評価項目:初回ARSI治療の中止、他のARSIへの切り替え、転移病変の確認、mCRPCの診断、mCRPCに対する薬物治療の開始[アビラテロン、ドセタキセル、カバジタキセル、Sipuleucel-T(国内未承認)、ミトキサントロン(国内適応外)、塩化ラジウム(223Ra)]、または死亡のうちいずれか最も早い発生と定義した。
保険加入が不明および/またはベースラインPSA値が欠測している79例を除外した791例(ニュベクオ群 328例、エンザルタミド群 341例、アパルタミド群 122例)が、Cox比例ハザード回帰モデルに組み入れられた。調整Cox比例ハザード回帰モデルには、次のベースライン特性が組み入れられた:index dateにおける年齢グループ(≦74歳、75~84歳、≧85歳)、人種(黒人/アフリカ系アメリカ人、白人、その他/不明)、保険加入(民間、公的)、index dateの時期(2019~2020年、2021~2022年)、ベースラインPSA値グループ(<2、≧2~<10、≧10ng/mL)、ベースラインPSADTグループ(≦6、>6~≦10、>10ヵ月、欠測)、nmCRPC診断からindex dateまでの期間(月)、前立腺癌初回診断時のGleasonスコア(4~7、8~10、欠測)。
初回ARSI治療の中止までの期間①
初回ARSI治療を中止した患者
| ニュベクオ群(n=362) | エンザルタミド群(n=382) | アパルタミド群(n=126) | |
|---|---|---|---|
| イベント数 | 110(30.4%) | 156(40.8%) | 58(46.0%) |
主な中止理由(担当医による評価)
- 有害事象:
ニュベクオ群 10.2%(37/362例)
エンザルタミド群 14.4%(55/382例)
アパルタミド群 15.1%(19/126例)
- mCRPCへの進行/死亡:
ニュベクオ群 8.3%(30例)
エンザルタミド群 12.0%(46例)
アパルタミド群 13.5%(17例)
Kaplan-Meier推定値
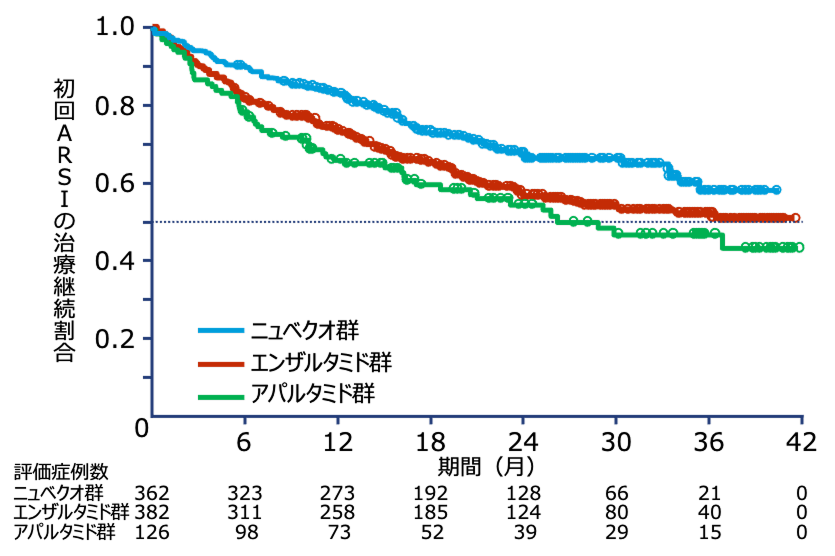
初回ARSI治療の中止:初回ARSI治療の中止、他のARSIへの切り替え、または死亡のうちいずれか最も早い発生と定義した。
初回ARSI治療の中止までの期間②
- 未調整Cox比例ハザード回帰モデルでは、ニュベクオ群で治療の中止リスクが低いことが示唆された
- ベースラインの共変量を調整後も、エンザルタミド群およびアパルタミド群に対するニュベクオ群のハザード比および95%CIの上限はいずれも1.00を下回っており、ニュベクオは治療の中止リスクの低下と関連していた

Cox比例ハザード回帰モデル
初回ARSI治療の中止:初回ARSI治療の中止、他のARSIへの切り替え、または死亡のうちいずれか最も早い発生と定義した。
保険加入が不明および/またはベースラインPSA値が欠測している79例を除外した791例(ニュベクオ群 328例、エンザルタミド群 341例、アパルタミド群 122例)が、Cox比例ハザード回帰モデルに組み入れられた。調整Cox比例ハザード回帰モデルには、次のベースライン特性が組み入れられた:index dateにおける年齢グループ(≦74歳、75~84歳、≧85歳)、人種(黒人/アフリカ系アメリカ人、白人、その他/不明)、保険加入(民間、公的)、index dateの時期(2019~2020年、2021~2022年)、ベースラインPSA値グループ(<2、≧2~<10、≧10ng/mL)、ベースラインPSADTグループ(≦6、>6~≦10、>10ヵ月、欠測)、nmCRPC診断からindex dateまでの期間(月)、前立腺癌初回診断時のGleasonスコア(4~7、8~10、欠測)。
mCRPCへの進行までの期間①
mCRPCに進行した患者
| ニュベクオ群(n=362) | エンザルタミド群(n=382) | アパルタミド群(n=126) | |
|---|---|---|---|
| イベント数 | 64(17.7%) | 108(28.3%) | 35(27.8%) |
Kaplan-Meier推定値

mCRPCへの進行:mCRPCの確定診断、患者の医療記録や画像診断報告書による転移の証拠、mCRPCに対する薬物治療の開始[アビラテロン、ドセタキセル、カバジタキセル、Sipuleucel-T(国内未承認)、ミトキサントロン(国内適応外)、塩化ラジウム(223Ra)]のうちいずれか最も早い発生と定義した。
mCRPCへの進行までの期間②
- 未調整Cox比例ハザード回帰モデルでは、ニュベクオ群でmCRPCへの進行リスクが低いことが示唆された
- ベースラインの共変量を調整後も、エンザルタミド群およびアパルタミド群に対するニュベクオ群のハザード比および95%CIの上限はいずれも1.00を下回っており、ニュベクオはmCRPCへの進行リスクの低下と関連していた

Cox比例ハザード回帰モデル
mCRPCへの進行:mCRPCの確定診断、患者の医療記録や画像診断報告書による転移の証拠、mCRPCに対する薬物治療の開始[アビラテロン、ドセタキセル、カバジタキセル、Sipuleucel-T(国内未承認)、ミトキサントロン(国内適応外)、塩化ラジウム(223Ra)]のうちいずれか最も早い発生と定義した。
保険加入が不明および/またはベースラインPSA値が欠測している79例を除外した791例(ニュベクオ群 328例、エンザルタミド群 341例、アパルタミド群 122例)が、Cox比例ハザード回帰モデルに組み入れられた。調整Cox比例ハザード回帰モデルには、次のベースライン特性が組み入れられた:index dateにおける年齢グループ(≦74歳、75~84歳、≧85歳)、人種(黒人/アフリカ系アメリカ人、白人、その他/不明)、保険加入(民間、公的)、index dateの時期(2019~2020年、2021~2022年)、ベースラインPSA値グループ(<2、≧2~<10、≧10ng/mL)、ベースラインPSADTグループ(≦6、>6~≦10、>10ヵ月、欠測)、nmCRPC診断からindex dateまでの期間(月)、前立腺癌初回診断時のGleasonスコア(4~7、8~10、欠測)。
全有害事象および特に注目すべき有害事象の発現状況
- 1件以上の有害事象が電子カルテに記録されていた患者の割合は、ニュベクオ群24.9%(90/362例)、エンザルタミド群29.3%(112/382例)、アパルタミド群30.2%(38/126例)であった
- 特に注目すべき有害事象が記録されていた患者の割合は、それぞれ14.9%(54例)、17.5%(67例)、22.2%(28例)であり、いずれのコホートにおいても発現頻度が最も高かったのは疲労であった
| ニュベクオ群 (n=362) | エンザルタミド群 (n=382) | アパルタミド群 (n=126) | |
|---|---|---|---|
| 全有害事象*、n(%) | 90(24.9) | 112(29.3) | 38(30.2) |
| 特に注目すべき有害事象、n(%) 疲労 皮疹 認知および記憶障害 転倒 高血圧 骨折 | 54(14.9) 41(11.3) 8(2.2) 5(1.4) 3(0.8) 1(0.3) 0 | 67(17.5) 53(13.9) 3(0.8) 8(2.1) 5(1.3) 3(0.8) 0 | 28(22.2) 14(11.1) 10(7.9) 3(2.4) 1(0.8) 0 0 |
*:ARSIの治療中および治療中止後30日以内に記録された有害事象。一部の患者では複数の有害事象が認められた。
※ 本論文には、安全性に関するこれ以上の情報は記載されていません。 ニュベクオの安全性に関する情報は、最新の電子添文をご参照ください。
まとめ
- DEAR試験はnmCRPCに対して承認されているARSI 3剤の実臨床における使用を単一のデータソースで評価した、初めての大規模コホート研究である。
- 本研究より、ニュベクオはエンザルタミドやアパルタミドに比べ、初回ARSI投与期間およびmCRPC進行までの期間を延長することが示唆された。
- ARSIの主な治療中止理由は、有害事象やmCRPCへの進行/死亡であった(有害事象:ニュベクオ群 10.2%、エンザルタミド群 14.4%、アパルタミド群 15.1%、mCRPCへの進行/死亡:それぞれ8.3%、12.0%、13.5%)。
- 直接比較された無作為化試験がない場合、治療選択の決定指針として、DEAR試験のような電子カルテデータの比較によるコホート研究が必要である。
Limitation
- 腫瘍進行の厳密な放射線学的評価に依存する臨床試験の有効性データとは対照的に、PPSにおける治療効果は、構造化/非構造化された患者記録から得られた実臨床の疾患進行評価データを用いて推定された。このような評価データは迅速かつ正確に記録されていない可能性があり、盲検化された独立評価はなく、追跡期間は短く、臨床検査や画像検査などの評価方法も標準化されていないため、DEAR試験で評価された特定の進行イベントが正しくなかった、あるいは最も早い時点で確認されなかった可能性がある。
- 電子カルテを用いたレトロスペクティブ解析では、一般的に患者と臨床医の過少報告により有害事象の発現率が低くなるとされており1)、安全性データの収集が不完全な可能性がある。研究変数の測定ミスや欠測に関連する限界は、治療コホート間で影響の程度が異なっていた場合にのみ結果に影響を与えるが、本研究におけるコホート間の患者特性のバランスを考慮すると、その可能性は低いと考えられる。
- 1) Di Maio M, et al.: Oncologist. 25; e746-e752, 2020.
ARAMIS試験の概要
非転移性去勢抵抗性前立腺癌を対象としたニュベクオの国際共同第Ⅲ相試験(海外データ、日本人データを含む)
試験概要
| 目的 | ハイリスクの非転移性去勢抵抗性前立腺癌患者を対象として、無転移生存期間(MFS)についてニュベクオのプラセボに対する優越性を検討する。 |
|---|---|
| 研究デザイン | 多施設共同、無作為化、二重盲検、プラセボ対照、第Ⅲ相試験 |
| 対象 | 化学療法歴のないPSA倍加時間(PSADT)が10ヵ月以下の非転移性*1去勢抵抗性前立腺癌患者 |
| 評価項目 | ニュベクオ群(955例)又はプラセボ群(554例)に2:1の割合で無作為化し、アンドロゲン遮断療法(ADT)継続下で盲検にて投与した。
遠隔転移が確認されるまで、または忍容できない有害事象が認められるまで投与を継続した。 |
| 評価項目 | 主要評価項目:無転移生存期間(MFS)*2 (検証的な解析項目) 副次評価項目:全生存期間(OS)、疼痛増悪までの期間、化学療法の初回開始までの期間、症候性骨関連事象(SSE)発現までの期間その他の評価項目:無増悪生存期間(PFS)、PSA増悪までの期間、PSA奏効率、QOLなど 安全性評価項目:有害事象、バイタルサイン、心電図、理学的検査、臨床検査 |
| 解析計画 |
|
MFS:Metastasis-Free Survival PSADT:PSA Doubling Time SSE:Symptomatic Skeletal Event
結果
MFS【主要評価項目:主解析時、検証的解析結果】

追跡期間中央値: 17.9ヵ月(主解析時のデータカットオフ: 2018年9月3日)
安全性:主解析時
安全性解析対象例における副作用は、ニュベクオ群で954例中258例(27.0%)、プラセボ群で554例中110例(19.9%)に認められた。グレード3以上の副作用は、ニュベクオ群で28例(2.9%)、プラセボ群で16例(2.9%)に認められた。
- 主な副作用(2%以上)は、ニュベクオ群で疲労68例(7.1%)、ほてり36例(3.8%)、悪心24例(2.5%)、プラセボ群で疲労24例(4.3%)、悪心17例(3.1%)、ほてり15例(2.7%)であった。
- 重篤な副作用は、ニュベクオ群で10例(1.0%)、プラセボ群で6例(1.1%)に報告された。
[ニュベクオ群における重篤例:尿閉、肺塞栓症、完全房室ブロック、伝導障害、小腸穿孔、肝機能異常、アラニンアミノトランスフェラーゼ増加、アスパラギン酸アミノトランスフェラーゼ増加、虚血性脳卒中、深部静脈血栓症、末梢性虚血 各1例(重複あり)]
[プラセボ群における重篤例:心筋梗塞、胃炎、高血糖、頭蓋内出血、一過性脳虚血発作、尿閉、肺塞栓症 各1例(重複あり)] - 投与中止に至った副作用は、ニュベクオ群で15例(1.6%)、プラセボ群で13例(2.3%)に報告された。
[ニュベクオ群における投与中止例:血中クレアチニン増加 2例、貧血、腹部不快感、下痢、悪心、小腸穿孔、歩行障害、アスパラギン酸アミノトランスフェラーゼ増加、好中球数減少、トランスアミナーゼ上昇、浮動性めまい、蕁麻疹、深部静脈血栓症、低血圧、末梢性虚血 各1例(重複あり)]
[プラセボ群における投与中止例:心筋梗塞、腹部膨満、上腹部痛、胃炎、悪心、疲労、頭蓋内出血、頭痛、一過性脳虚血発作、肺塞栓症、そう痒症、高血圧、血管炎 各1例] - 死亡に至った副作用は、ニュベクオ群で1例(小腸穿孔)、プラセボ群で2例(心筋梗塞、頭蓋内出血 各1例)であった。
- *1: 試験薬投与開始前42日以内に撮像した画像(骨シンチグラフィー、CT/MRI)で検知可能な転移が存在する患者、又は転移の既往のある患者は除外された(ただし、大動脈分岐部下の短径2cm未満の骨盤内リンパ節転移は許容)。
- *2: 無作為化時点から、転移が確認された日または死亡日(死因は問わず)のいずれか早い時点までの期間と定義した。
- *3: 層別化因子:PSADT(≦ 6ヵ月 vs > 6ヵ月)、ベースライン時の骨修飾薬投与(あり vs なし)

